LO QUE SE AFIRMA
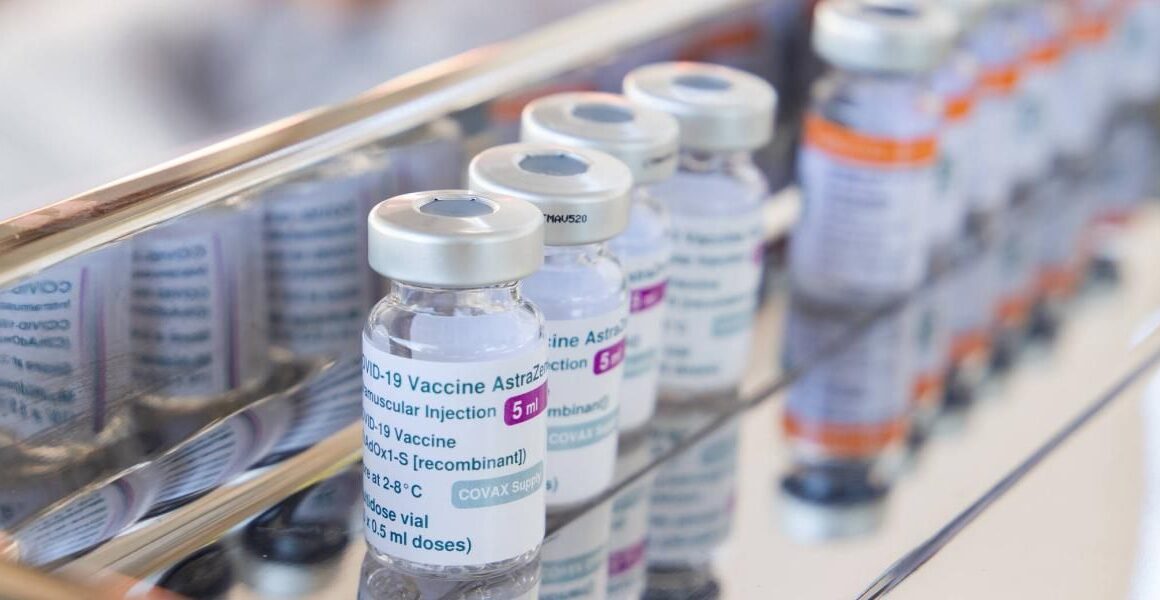
La Comisión Europea ha revocado la autorización de comercialización de la vacuna de AstraZeneca contra la COVID-19 porque es peligrosa para la salud de las personas.
LO QUE SABEMOS HASTA AHORA
La revocación de la autorización de comercialización de la vacuna de AstraZeneca contra la COVID-19 se ha realizado a petición de la propia empresa farmacéutica, que dejó de producir y distribuir su vacuna en la Unión Europea por falta de demanda y por la necesidad de adaptarse a las nuevas variantes del virus.